化试并对结果进行比较
目的不同:评价不同商品化试剂定量检测临床血清样本乙型肝炎病毒DNA(HBV DNA)性能的差异。方法:(1)应用5种商品化HBV DNA定量试剂(2种进口试剂A和B,商品3种国产试剂C、D和E)分别对6例混合血清样本进行检测,化试并对结果进行比较;3种国产试剂对6例混合血清样本以及103和106两个水平的剂对检测结果HBV DNA国家标准物质GBW(E)090137和GBW(E)090139分3个批次检测,分析其精密度和正确度。临床(2)采用3种国产试剂定量检测43例慢性乙型肝炎患者血清样本HBV DNA,血清响并分析其相关性和一致性。结果:(1)定量检测6例混合血清样本中HBV DNA,样本试剂B、C与A的定量的影检测结果差异均无统计学意义(P>0.05),而试剂D、E的不同检测结果均显著低于试剂A(P<0.05)。(2)定量检测6例混合血清样本以及103和106两个水平的商品HBV DNA国家标准物质,3种国产试剂的化试CV均小于5%,国家标准物质的实际检测值与靶值的差值绝对值均小于0.4 log10 IU/mL,精密度和正确度满足行业标准。(3)对于43例临床血清样本,剂对检测结果试剂C、临床D和E的血清响阳性检出率分别为95.35%(41/43)、95.35%(41/43)、样本86.05%(37/43);对于检测结果均在3种试剂定量范围内的24例临床血清样本,HBV DNA定量检测结果为C>D>E(P<0.05),3种试剂的检测结果两两间均呈线性相关(C vs D:R2=0.93,Y=0.973X-0.164;C vs E:R2=0.61,Y=0.770X+0.210;D vs E:R2=0.69,Y=0.809X+0.270),试剂C和D、C和E、D和E的Bland-Altman分析发现其检测结果差值平均值分别为0.28、0.80和0.51 log10 IU/mL,相应的95%一致性界限分别为(-0.30,0.86)、(-0.62,2.21)、(-0.74,1.77),相应的95%一致性界限以内的点分别占95.83%(23/24)、95.83%(23/24)和91.67%(22/24),其一致性界限范围内检测值的最大差异分别为0.85、1.96和1.25 log10IU/mL。试剂C和D、C和E、D和E的检测结果差值>1.0 log10 IU/mL的血清样本分别占0(0/24)、33.33%(8/24)和25.00%(6/24)。结论:满足行业标准的不同商品化国产试剂定量检测临床血清样本HBV DNA的性能存在显著差异,在常规临床实践中互换用于临床决策时务必慎重。
乙型肝炎病毒(hepatitis B virus,HBV)感染是一个严重的全球公共卫生问题,据估计全球有2.92亿HBV感染者(HBsAg阳性),其中我国约有8600万。HBV可造成慢性感染,进而发展为肝硬化和肝细胞癌,危及患者生命。血清中高水平HBV DNA已被确定为肝硬化和肝细胞癌的主要危险因素。通过抗病毒治疗抑制HBV DNA复制,是预防和延缓慢性乙肝患者进展为肝硬化、终末期肝病和肝细胞癌的重要措施。敏感、准确定量HBV DNA在确定HBV感染阶段、治疗指征、治疗终点、监测治疗反应以及早期识别耐药中起着至关重要的作用。国际肝病协会对于HBV DNA超敏定量检测的试剂要求包括高灵敏度10~15 IU/ml、宽线性范围1~9 log10 IU/mL、特异性强和重复性好。对于大多数患者HBV管理需要长期监测HBV DNA,同一患者可能在不同的医院监测其体内病毒载量,而不同的医院实验室可能应用不同的检测试剂。目前我国市场上有多种进口和国产的商品化HBV DNA超敏定量试剂,并且均已获国家药品监督管理局(NMPA)批准,其中罗氏的AmpliPrep/COBAS TaqMan(CAP/CTM)HBV诊断试剂和雅培的RealTime HBV诊断试剂是目前国际上通用的HBV DNA检测试剂,前者在国际上应用更广泛。由于不同商品化试剂的检测性能可能存在差异,而临床上不同的实验室采用不同的商品化试剂定量检测特定患者血清中HBV DNA,可能导致其检测结果不同。因此,本研究主要拟对3种不同商品化国产试剂定量检测临床血清样本中HBV DNA的结果进行比对,以评价不同试剂的临床性能以及在常规临床实践中互换使用的可接受性。
1材料与方法
1.1标本来源
收集2019年4月我院收治的慢性HBV感染患者血清若干份,制备成6个浓度的混合血清,用于检测。收集2019年7月我院收治的43例慢性HBV感染患者血清样本,其中男25例,女18例,年龄20~70岁。
1.2仪器与试剂
AmpliPrep/COBAS TaqMan(CAP/CTM)HBV诊断试剂(试剂A,罗氏);RealTime HBV诊断试剂(试剂B,雅培);3种国产HBV核酸定量检测试剂(分别为试剂C、D和E);乙型肝炎病毒核酸(HBV DNA)血清标准物质GBW(E)090137和GBW(E)090139(北京康彻斯坦生物技术有限公司)。COBAS®AmpliPrep/COBAS®TaqMan®病毒载量检测系统(罗氏);M2000病毒载量检测系统(雅培);三家国产试剂相配套的半自动磁珠式核酸提取仪;COBAS®Z480全自动荧光定量PCR分析仪(罗氏)。
1.3方法
分别用6种试剂对6例混合血清样本进行平行检测(表1),试剂A和B分别检测一次,试剂C、D和E各分3批进行3次检测。试剂A和B分别采用各自配套的封闭系统进行核酸提取和扩增;试剂C、D和E分别采用各自配套的半自动磁珠式核酸提取仪进行核酸提取,扩增均在COBAS®Z480全自动荧光定量PCR分析仪上进行。具体操作步骤严格按照试剂说明书进行。
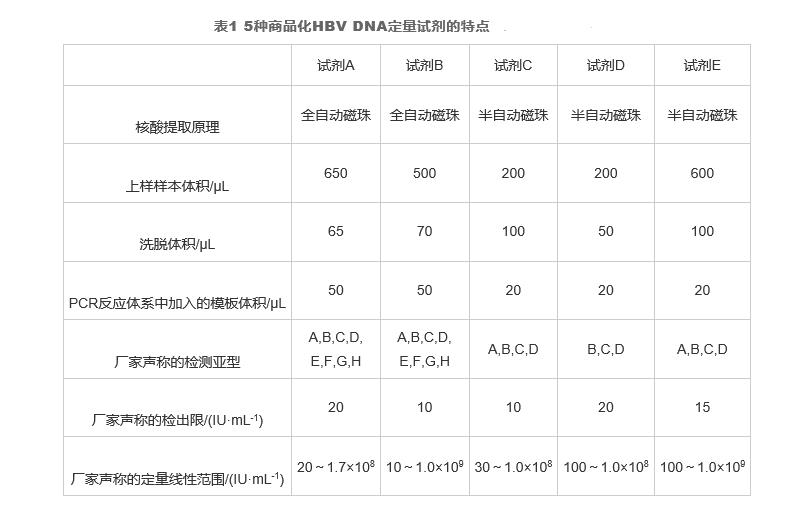
分别用3种国产试剂C、D、E对43例慢性HBV感染患者血清样本进行平行检测。核酸提取分别采用各自配套的半自动磁珠式核酸提取仪进行,扩增均在COBAS®Z480全自动荧光定量PCR分析仪上进行。具体操作步骤严格按照试剂说明书进行。
各试剂每批次均做阴性对照和北京康彻思坦生物技术有限公司生产的GBW(E)090137(靶值1.41×103 IU/mL)、GBW(E)090139(靶值4.6×106 IU/mL)两个水平的HBV DNA血清标准物质。结果判读严格按照试剂说明书进行。确保质控在控后再进行结果分析。
定性检测结果以检出或未检出表示,低于相应试剂厂家声称的检出限判定为未检出。只有超过该试剂声称的定量下限且在其定量线性范围的定量检测结果用于进一步分析。
1.4统计学分析
所有检测结果均以log10 IU/mL表示,采用SPSS 17.0和Medcalc 15.2.2软件进行统计学分析。呈正态分布的计量资料以x±s表示,采用配对样本t检验;非正态分布的计量资料,采用Wilcoxon符号秩和检验;计数资料采用配对χ2检验;两种检测方法的相关性分析采用Pearson相关性以及线性回归分析;采用Bland-Altman图分析两种检测方法的一致性。P<0.05为差异有统计学意义。
声明:本文所用图片、文字来源《临床血液学杂志》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系删除。
相关链接:血清样本,乙型肝炎病毒,标准物质
相关阅读
- 银临献唱《小倩》同名片尾曲 虐心演绎生死相随
- 江西赣州:维护网络市场秩序 提升示范创建成色
- 那么多玻璃,你真的了解吗?,行业资讯
- Tommy 22秋冬新系列 休闲户外 主张自我个性
- LIKE A COOL KID喜粤TV第三届少女街舞展演广州站完好支民
- 智能门窗或将呈现出五大变革趋势,行业资讯
- 北京启动空气质量专项督查,行业资讯
- no added sugar时尚T恤 延续经典 诠释流行
- 社保医保大病险保费多少钱一年
- 诺帝卡时尚品牌 塑造挺括身形率性迷人
- 科学认知特殊食品|创新“发声” 用心贴近民生 江西省九江市特殊食品科普宣传侧记
- 那么多玻璃,你真的了解吗?,行业资讯
- 2024天津玛雅海滩水公园开园时候
- 福建厦门开展执法稽查职业技能竞赛
- 福建厦门:精准施策帮扶 为“双百项目”保驾护航
- 一种崂山红茶冻凝胶食品的研究与开发(二)
- 前后单屏设念,借有8+256G超大年夜大年夜内存,飞利浦新机线上初次露脸
- 武汉东湖高新区市场监管局荣获湖北省“人民满意的公务员集体”称号
- 重庆启动食品行业“百企千坊万家”纾困解难行动
- 预计2019年大陆将成为大部分国家非常大面板产能基地,行业资讯
